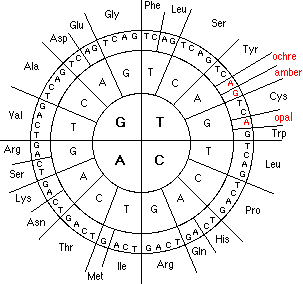
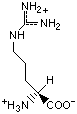
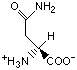
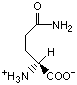
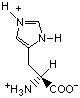
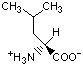
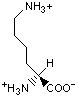
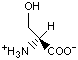
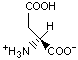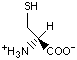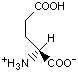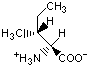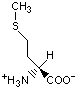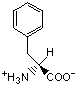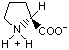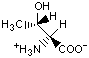Гидрофобность аминонокислот.
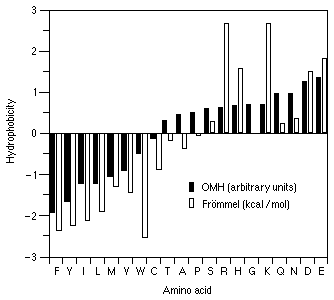
Гидрофобность аминокислот выражает степень в которой они предпочитают неполярное окружение (этанол в качестве растворителя или внутренность белка) по сравнению с полярным окружением, таким как вода. На этой диаграмме гидрофобные аминокислоты располагаются ниже нуля, а гидрофильные - выше.
Используются две шкалы. Шкала Фроммеля (Frommel, 1984) выражает свободную энергию переноса из гидрофобной среды в воду. Это внутреннее свойство аминокислоты, не зависящее от роли аминокислоты в белке. OMH шкала (Sweet and Eisenberg, 1983) - мера того, на сколько вероятна замена данной аминокислоты другой гидрофобной аминокислотой.
Frommel, C. 1984. The apolar surface area of amino acids and its empirical correlation with hydrophobic free energy. J. Theor. Biol. 111:247-260.
Sweet, R.M. and Eisenberg, D. 1983. Correlation of sequence hydrophobicities measures similarity in three-dimensional protein structure. J. Mol. Biol. 171:479-488.
Относительная оценка подобия аминокислот.
Свойства аминокислот.
Амино-
кислота | Непол.,
Гидро-
фобные |
Полярные | Отн.
мутаб.1 | Гидро-
фобн.2 | hydro-
philicity
value3 | hydro-
paty
index4 | Вероятн.
нахожд. на
поверхн.5 | Встре-
чаемость |
Незаря-
женные |
Гидро-
фильные |
| Alanine | | | | 100 | -0.4 | -0.5 | 1.8 | 62 | 8.3 |
| Arginine | | | | 65 | -0.59 | 3.0 | -4.5 | 99 | 5.7 |
| Asparagine | | | | 134 | -0.92 | 0.2 | -3.5 | 88 | 4.4 |
| Aspartic acid | | | | 106 | -1.31 | 3.0 | -3.5 | 85 | 5.3 |
| Cysteine | | | | 20 | 0.17 | -1.0 | 2.5 | 55 | 1.7 |
| Glutamic acid | | | | 102 | -1.22 | 3.0 | -3.5 | 82 | 6.2 |
| Glutamine | | | | 93 | -0.91 | 0.2 | -3.5 | 93 | 4.0 |
| Glycine | | | | 49 | -0.67 | 0.0 | -0.4 | 64 | 7.2 |
| Histidine | | | | 66 | -0.64 | -0.5 | -3.2 | 83 | 2.2 |
| Isoleucine | | | | 96 | 1.25 | -1.8 | 4.5 | 40 | 5.2 |
| Leucine | | | | 40 | 1.22 | -1.8 | 3.8 | 55 | 9.0 |
| Lysine | | | | 56 | -0.67 | 3.0 | -3.9 | 97 | 5.7 |
| Methionine | | | | 94 | 1.02 | -1.3 | 1.9 | 60 | 2.4 |
| Phenylalanine | | | | 41 | 1.92 | -2.5 | 2.8 | 50 | 3.9 |
| Proline | | | | 56 | -0.49 | 0.0 | -1.6 | 82 | 5.1 |
| Serine | | | | 120 | -0.55 | 0.3 | -0.8 | 78 | 6.9 |
| Threonine | | | | 97 | -0.28 | -0.4 | -0.7 | 77 | 5.8 |
| Tryptophan | | | | 18 | 0.50 | -3.4 | -0.9 | 73 | 1.3 |
| Tyrosine | | | | 41 | 1.67 | -2.3 | -1.3 | 85 | 3.2 |
| Valine | | | | 74 | 0.91 | -1.5 | 4.2 | 46 | 6.6 |
|
1 - чем ниже, тем менее вероятна мутация соответствующей АА.
2 - гидрофобность - произвольные единицы основанные на OHM шкале, которые выражают возможность замены одной аминокислоты другой в ходе эволюции.
Sweet, R.M. and Eisenberg, D. 1983. Correlation of sequence hydrophobicities measures similarity in three-dimensional protein structure. J. Mol. Biol. 171:479-488.
3 - Hopp, T.P. and Woods, K.R. 1981. Prediction of protein antigenic determinants from amino acid sequences. Proc. Natl. Acad. Sci. U.S.A. 78:3824-3828.
4 - Kyte, J. and Doolittle, R.F. 1982. A simple method for displaying the hydropathic character of a protein. J. Mol. Biol. 157:105-132.
5 - вероятность того, что>5% поверхности аминокислоты соприкасается с раствором, окружающим белок.
Конверсия: масса - моли (белок).
| Mw (kDa) | 1µg | 1nmol |
| 10 | 100pmol, 6x1013шт. | 10µg |
| 50 | 20pmol, 1.2x1013шт. | 50µg |
| 100 | 10pmol, 6x1012шт. | 100µg |
| 150 | 6.7pmol, 4x1012шт. | 150µg |
|
|