Комментарии.
Общие.
- Источник: "MATCHMAKER GAL4 Two-Hybrid System 2 User Manual", Clontech.
- Если требуется максимальная компетентность, то клетки следует использовать в течении часа после приготовления. При необходимости клетки можно использовать и через несколько часов, но их компетентность будет несколько ниже.
- Компетентность получается примерно 104-105 колоний/µg плазмиды.
- AD плазмида кодирует домен активации, BD плазмида - домен связывания. В двугибридной системе "MATCHMAKER GAL4 Two-Hybrid System 2" используются AD и BD домены дрожжевого транскрипционного фактора GAL4. Соответствующие вектора называются pACT2 и pAS2-1.
- В качестве BD домена также часто используется бактериальный белок LexA.
- В данной двугибридной системе используются дрожжи дефектные по синтезу лейцина, триптофана и гистидина и не способные расти на среде без этих аминокислот. Плазмида pACT2 содержит ген LEU2, плазмида pAS2-1 ген TRP1. Дрожжи трансформированные pACT2 могут расти на среде SD-leu, трансформированные pAS2-1 - на среде SD-trp, обеими плазмидами - на среде SD-leu-trp. Колонии растут на среде SD-leu-trp-his, если содержат AD и BD плазмиды, кодирующие два взаимодействующих белка, так как в этом случае происходит активация репортерного гена HIS3.
По пунктам.
п. 1.
- Среда в эппендорфе должна стать заметно мутной.
п. 1,2.
- Для подроста дрожжей, предварительно трансформированных плазмидой, использовать селективную среду (либо SD-leu, либо SD-trp в зависимости от типа плазмиды). Для подроста нетрансформированных дрожжей использовать YPD.
п. 3.
- Должны подрости до OD600>1.5.
п. 5.
- Должны подрости примерно до OD600=0.5.
п. 6.
- Можно осадить за несколько раз.
п. 11.
- Для трансформации AD и BD плазмид можно использовать как одновременную трансформацию, так и последовательную. При последовательной трансформации сначала трансформируется одна плазмида, затем подращиваются трансформированные дрожжи в селективной среде, из них готовятся новые компетентные клетки и в них трансформируется вторая плазмида. Эффективность последовательной трансформации значительно выше, но требует дополнительного времени на подрост дрожжей после первой трансформации.
- Непосредственно перед использованием денатурировать геномную ДНК в кипящей бане 10', сразу в лед.
|
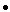 плазмида BD: 0.1µg
плазмида BD: 0.1µg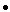 плазмида AD: 0.1µg
плазмида AD: 0.1µg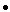 геномная ДНК: 100µg;
геномная ДНК: 100µg;