> Методы > Двугибридная система > Трансформация дрожжей кДНК библиотекой.
Трансформация дрожжей кДНК библиотекой.
Этот метод используется для трансформации дрожжей кДНК библиотекой, в дрожжевой двугибридной системе от Clontech.
Для трансформации дрожжей индивидуальной плазмидой следует использовать этот протокол..
- Рассеять дрожжи со стока (-70oC) на YPD чашку;
- Растить при 30oC (примерно 1-2 дня);
- Трансформировать дрожжи BD плазмидой используя этот протокол;
- Высеять на чашку SD-trp;
- Растить при 30oC (примерно 3 дня);
- Суспендировать десяток колоний в 1ml SD-trp среды;
- В колбу с 150ml SD-trp среды посеять 1ml дрожжей из п.6;
- Растить 16-18h при 30oC;
- В колбу с 1L YPD посеять ночную культуру до OD600=0.2-0.3;
- Растить 3h при 30oC;
- ЦФ в 50ml нунках 5', 4500rpm, RT;
- Суспендировать осадок в 500ml H2O;
- ЦФ 5', 4500rpm, RT;
- Суспендировать осадок в 8ml свежеприготовленного раствора "TE/LiAc";
- Приготовить 100ml раствора "PEG/LiAc";
- Cмешать:
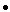 кДНК библиотека в векторе AD: 500µg
кДНК библиотека в векторе AD: 500µg
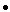 геномная ДНК: 20mg;
геномная ДНК: 20mg; - Добавить 8ml компетентных клеток, хорошо смешать;
- Добавить 60ml раствора "PEG/LiAc";
- Бактериальная качалка, 30oC, 30';
- Добавить 7ml DMSO, мягко смешать;
- Heat shock 42oC, 15', периодически смешивать, переворачивая пробирки;
- Охладить клетки во льду 2';
- ЦФ 5', 4500rpm, RT;
- Суспендировать осадок в 10ml 1xTE;
- Высеять на три чашки SD-leu-trp аликвоты с десятикратным разведением:
1. 500µl 1xTE + 10µl дрожжей из п.24 (1/1000 от общего объема)
2. 500µl 1xTE + 50µl из пробирки 1
3. 500µl 1xTE + 50µl из пробирки 2; - Высеять все дрожжи из п.24 на среду SD-leu-trp-his. Использовать 5-10 чашек размером 20x20см;
Приготовление компетентных клеток.
Трансформация кДНК библиотекой.