Комментарии.
Общие.
- Следует обратить внимание на то, что под параметрами PCR (температура, время) можно понимать две, несколько различающиеся вещи:
а) те цифры, которые введены в PCR машину;
б) те значения параметров, которые имеют место в пробирке.
Мы не пытаемся намекнуть на то, что прибор может быть неисправным (хотя и это возможно). Мы, опять таки, не имеем ввиду различие между двумя приборами одного типа - обычно на них можно не обращать внимание.
Мы хотим сказать, что для различных типов приборов связь между (а) и (б) может быть принципиально различна.
Рассмотрим реализацию прибором двух шагов температурного цикла:
Tа=44oС, 30'',
Tc=72oC, 1'.
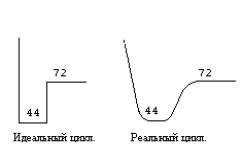
а) реальный цикл - гладкая кривая с конечными производными. На сколько близка эта кривая к идеальной определяется техническими возможностями прибора. Имеется принципиальная неопределенность (тем большая, чем дальше кривая от "идеальной") в том что же считать моментом начала и конца цикла. Создатели прибора определяют это, исходя из своих предпочтений.
б) смена температур не происходит мгновенно. Разные приборы имеют разную скорость изменения температуры. Этот факт имеет принципиальное значение для PCR (если бы скачек между 44oС и 72oС происходил "мгновенно", отожженные праймеры просто свалились бы с матрицы. Именно благодаря тому, что Taq pol. успевает удлинить их во время нагрева, они удерживаются.)
Как только речь заходит о "температуре в пробирке" появляются дополнительные сложности:
- распределение температуры неоднородно по площади нагреваемого элемента;
- вид температурной кривой зависит от объема реакционной смеси в пробирке;
- пластик пробирки - неплохой теплоизолятор. Различные типы пробирок (0.2ml, 0.5ml, 96-луночная плашка, 384-луночная плашка) имеют разные теплоизолирующие свойства.
Нам кажется, что по "степени влияния" перечисленные выше факторы можно распределить в следующем порядке:
- Смена типа пробирок (0.5ml; 0.2ml; 96-луночная плашка, 384-луночная плашка) может потребовать очень существенных изменений параметров PCR.
- Смена типа прибора - могут понадобиться минорные изменения (главным образом, времени циклов).
- Смена объема реакции: обычно используются 0.5ml пробирки (25-100µl) и 0.2ml пробирки (5-100µl). Лучше не превышать 100µl, т.к. это может вызвать серьезные проблемы со временем разогрева и охлаждения.
По пунктам.
Предварительный нагрев.
- Начальная денатурация матрицы. Если матрица одноцепочечная или PCR-продукт, этот этап лучше опустить.
- Кольцевая pDNA - умеет ренатурировать после тепловой денатурации. 95oC, 1' - компромисс при котором, с одной стороны некоторая часть плазмид никуется и превращается в одноцепочечные продукты, а с другой стороны, не слишком большая часть матриц повреждается.
Количество циклов.
- Число циклов обычно 25-35. Слишком большое число циклов чревато насыщением PCR реакции:
- ограничение по праймерам: синтез длинных продуктов, образованных в результате использования в качестве праймера готового продукта,
- ограничение по нуклеотидам: большая доля одноцепочечных продуктов, синтез коротких продуктов.
Td (denaturation)
- Температура и время денатурации выбираются как компромисс между двумя желаниями:
* "хорошо" денатурировать матрицу,
* не сильно повредить матрицу и Taq полимеразу.
Проблема в том, что DNA разрушается при нагреве. Скорость разрушения зависит от буфера (при 96.5oC: H2O->2.5'; TE->7.5'; 20mM Tris, pH9.0->~10')
Время "полураспада" Taq полимеразы в зависимости от температуры:
| 92.5oС | 130' |
| 95.0oС | 40' |
| 97.5oС | 5-6' |
|
- Время денатурации сильно зависит от типа используемых пробирок. Для тонкостенных 0.2 ml достаточно 10-15'' на 94oС.
Ta (annealing)
- Отжиг праймеров.
Более высокая температура - более высокая специфичность. Но как только она превышает некую критическую (для данной пары праймеров) количество продукта начинает резко снижаться.
Обычно мы выбираем температуру отжига на 1-2oС меньше, чем температура плавления олигонуклеотидов. Хотим обратить внимание начинающих пользователей компьютерных программ, что хорошие программы требуют для определения Tm задания двух параметров:
* концентрации праймеров;
* концентрации соли.
Концентрация соли = [Na+]+[K+]+0.7[Tris]. Для приведённого у нас буфера => 57mM.
- В "серьезных" случаях (очень большое количество PCR с определённым праймером или реакции, в которых одна и та же пара праймеров амплифицирует сложный набор фрагментов) имеет смысл подобрать температуру экспериментально. Критерии подбора:
- Ta - слегка меньше (~1oC), чем температура, при которой начинает снижаться количество продукта;
- желательно, чтобы Taбыла чуть больше температуры, при которой уже не образуются праймер-димеры в реакции без матрицы.
Тe (elongation)
- Этап, на котором происходит основной синтез DNA. Широко распространено использование Те= 72oС, т.к. на этой температуре полимеразная активность максимальна (она определяется по включению метки в денатурированную и отожженную salmon sperm DNA, взятую в большом избытке). Однако, Те= 72oС приемлема не для всех случаев:
=> В описании этого эксперимента есть важный момент, который нужно иметь ввиду: матрица взята в большом избытке, то есть, полимераза имеет возможность "пренебрегать" неудобными участками синтеза DNA. В реальном процессе полимеразе необходимо пройти все имеющиеся в наличии участки. Оказывается, что при температуре ~65oC синтез существенно меньше зависит от характера матрицы (но даже эта температура слишком велика для буфера с бетаином).
=> Матрицы с А-Т содержанием ~90% удаётся амплифицировать только снизив Те до ~60oС ( при этом скорость синтеза: 1kb/min).
- Время синтеза определяется скоростью работы Taq-pol.
| 75-80oС | ~150 нукл/сек | ~9 kb/min |
| 70oС | >60 нукл/сек | >3.6 kb/min |
| 55oС | 24 нукл/сек | 1.4 kb/min |
| 37oС | 1.5 нукл/сек | 190 нукл/min |
| 22oС | 0.25 нукл/сек | 15 нукл/min |
|
Пост-PCR.
- Считается, что циклы после PCR преследуют 2 цели:
- превращение некоторого остаточного количества одноцепочечных матриц (подвижность на форезе ниже) в двухцепочечные (более прямой способ решить эту задачу - провести несколько дополнительных (2-5) циклов без денатурации: только отжиг и удлинение);
- А-удлинение двухцепочечных PCR-продуктов (для клонирования в Т-вектор). Было показано, что этот процесс требует значительного времени (до 1h).
В случае, если решаемая задача не зависит от названных пунктов, пост-PCR этап можно не проводить.
4oC.
- По нашему мнению использовать PCR машину в качестве холодильника - не лучший способ ее применения (речь идет о постановке PCR ON). Кроме того, лучше сразу переходить к следующему этапу, если продукт реакции используется для клонирования или каких либо других "высоких" целей.
Проведение реакции.
- Ячейки PCR машины должны быть чистыми. Чистить хлопковой ватой, смоченной в 50% смеси изопропанол:вода.
384- и 96-луночные ячейки PCR машины хорошо бы обработать Teflon-spray. Это позволит легко вынимать плашки из машины.
- PCR-mix.
Удобно использовать смеси:
- все, кроме матрицы и Taq-pol.
хранить при -20oС продолжительное время, при 4oС - несколько суток;
- все, кроме матрицы и праймеров.
хранить при -70oС и -20oС продолжительное время, при 4oС несколько недель.
- все, кроме матрицы.
Хранить при -70oС и -20oС продолжительное время, при 4oС не более суток. 1х замораживание-оттаивание не меняет эффективность работы Taq полимеразы.
- Один из наиболее простых способов быстро проконтролировать прошёл или не прошёл PCR: добавить в реакционную смесь (без крезолового красного) EtBr до ~0.1 µg/ml (ещё до реакции).Если после PCR осветить пробирки UV, то светиться будут лишь те, в которых образовалось достаточное количество двухцепочечной DNA.
Удаление масла после PCR.
Мы применяем два способа:
для 0.2-0.5ml пробирок.
* заморозить на -20oС. Вода замёрзнет, масло – нет;
* отсосать масло вакуумным насосом;
* можно, дополнительно, сполоснуть охлаждённым (~4oС) хлороформом.
для 96-луночных плашек фирмы "Techne".
* положить плашку на поверхность жидкого азота, дать замёрзнуть и воде и маслу ~5' (масло при этом потрескается);
* перевернуть плашку, постучать (масло высыпается, вода остаётся).
