Комментарии.
По пунктам.
п. 1.
- Отмывка клеток от ростовой среды.
п. 4.
- Клетки ресуспензируются в изотоническом растворе.
п. 5.
- NP-40 лизирует клеточную оболочку, но не повреждает ядерную.
п. 7-10.
- Удаление цитоплазмы, получение суспензии ядер. Важно хорошо суспензировать ядра, иначе комочки ядер покроются вязкой "шубой" DNA, которая защитит их внутренность от проникновения SDS и ProtK;
п. 11.
- Лизис ядер. Требования, предъявляемые в п.11 противоречивы. Для того, чтобы получить полный лизис, требуется хорошо смешать суспензию ядер с раствором II, однако, интенсивное смешивание грозит дроблением геномной DNA. Мы поступаем следующим образом:
- непосредственно перед внесением (<1') Buf.II вновь взболтать суспензию ядер: вортекс - 2-4'';
- быстро внести Buf.II; сразу же закрыть пробирку; резко встряхнуть 2-3 раза. Для того, чтобы вскрыть ядра, раствору с SDS требуется несколько секунд. надо уложиться со встряхиванием в это время;
- через ~1' медленно перевернуть пробирку 2-3 раза.
- Можно хранить 1-2 дня при 4oС.
п. 12.
- Расщепление белков ProtK.
п. 13.
- Экстракция должна быть мягкой, для того, чтобы не раздробить механически длинную геномную DNA. Мы проводим её либо покачивая пробирку (+45o) ~10' с частотой ~11/сек, либо вращая их вокруг своей оси ~0.5-11/сек
п.14.
- Центрифугирование после первой экстракции органическими растворителями выполняются в два этапа, т.к. оставшиеся в растворе крупные частицы (не лизировавшие ассоциаты ядер, ...) при быстром центрифугировании могут увлечь с собой или повредить геномную DNA.
п.16.
- Осаждение EtOH требует меньшей работы и выполняется существенно быстрее, чем диализ, но размер DNA получается при этом заметно меньше. Из-за трудоемкости, диализ стоит применять только в том случае, если планируется использовать DNA для создания геномной библиотеки. Для всех остальных применений вполне достаточно осаждения EtOH.
п. 19.
- Стоит иметь ввиду, что замораживание-оттаивание уменьшает размер DNA, а долгое хранение при 4oС чревато заростом, поэтому нужно стараться использовать DNA после диализа как можно скорее.
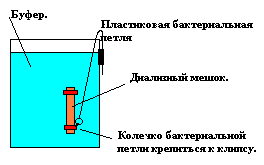
- Диализ: диализный мешок нужно сполоснуть H2O и зажать клипсом один его конец. Нужно как-то пометить этот конец, т.к. после диализа именно через него нужно сливать DNA (на другом конце внутри клипса сохранится неотдиализованная => грязная DNA). Мы проводим диализ в конструкции, показанной на рисунке. Держатель, изготовленный из пластиковой одноразовой бактериальной петли крепится на банке скотчем.
|
