> Методы > Фаг лямбда > Выделение ДНК (качественное).
Выделение ДНК фага лямбда для приготовления вектора.
- заранее подготовить ночную культуру клеток: 2-3ml LTB/Mg/мальтоза, в 17ml пробирке, бактериальная качалка 200-300rpm, 30oС, ON;
- пастеркой выколоть бляшку в 200µl SM + капля хлороформа;
- 2 часа на качалке или в холодильнике ON;
- к 50µl клеток + 1/2 суспензии фага, 37oС, 30';
- фаг/клетки -> в 60ml LTB/Mg в колбе V>150ml;
- бактериальная качалка 250-300rpm, 6-8 часов 37oС;
- + 1ml хлороформа, встряхивать 5';
- 54ml -> в центрифужную пробирку, охладить до NT;
- + DNase и RNase до 5µg/ml (по 27µl стоковых [10µg/µl] растворов);
- NT, 30';
- + NaCl (тв.) до 1М (3.15g);
- 0oС, 15';
- ЦФ 11kg, 4oС, 10';
- супер слить через марлю в пробирку с 5.4g PEG 8000;
- 0oC 1h;
- ЦФ 11kg, 4oС, 10', слить жидкость;
- ЦФ еще 3', отсосать остатки жидкости;
- используя пипетку с широким отверстием мягко ресуспензировать осадок в SM (1.6ml на 100ml исходной культуры);
- экстрагировать PEG и клетки равным объемом хлороформа: вортекс 30''; ЦФ 3kg, 4oС, 15';
- на каждый ml суспензии + 0.5g CsCl (тв.);
- в ультрацентрифужной пробирке приготовить ступенчатый градиент CsCl. Отметить положение границы 1.50-1.45. наслоить на градиент суспензию из п.21:
если прошёл "хороший лизис":
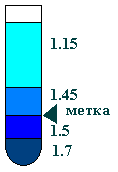
(Ti 50) 38krpm, 4oC, 24 h,
(SW 50.1) 35krpm, 4oC, 24 h;
EDTA 0.5M pH8.0 до 20mM,
ProtK 20µg/µl до 50-100µg/ml,
SDS 10% до 0.5%;
Рестрикция, дефосфорилирование, отжиг (совмещен с тепловой инактивацией рестриктазы).
(33-38 - optional):
1/10V AcONa
2xV EtOH, осадить,
H2O 70µl,
CIAP буфер 10µl,
CIAP 1u/µl 0.7µl;
EDTA pH8.0 0.5M 1µl,
ProtK 20µg/µl 1.5µl,
SDS 10% 5µl;
10µl AcONa,
220µl EtOH, осадить,